Identifikasi Aldehida dan Keton
senin, 12 November 2012
1.Mempelajari
dan memperkenalkan salah satu metode identifikasi senyawa berdasarkan
perbedaan gugus fungsi.
2.Memberi
pemahaman identifikasi secara kimia senyawa golongan aldehid dan
keton.
II.
Dasar Teori
Salah
satu gugus fungsi yang kita yaitu aldehid. Aldehid adalah suatu
senyawa yang mengandung sebuah gugus karbonil yang terikat pada
sebuah atau dua buah atom hidrogen. Nama IUPEC dari aldehida
diturunkan dari alkana dengan mengganti akhiran “ana“ dengan
“al“. Nama umumnya didasarkan nama asam karboksilat ditambahkan
dengan akhiran dehida (Petrucci, 1987).
Aldehid
dinamakan menurut nama asam yang mempunyai jumlah atom C sama pada
nama alkana yang mempunyai jumlah atom sama. Pembuatan aldehida
adalah sebagai berikut: oksidasi alkohol primer, reduksi klorida
asam, dari glikol, hidroformilasi alkana, reaksi Stephens dan untuk
pembuatan aldehida aromatik (Fessenden, 1997).
Salah
satu reaksi untuk pembuatan aldehid adalah oksidasi dari alkohol
primer. Kebanyakan oksidator tak dapat dipakai karena akan
mengoksidasi aldehidnya menjadi asam karboksilat. Oksidasi
khrompiridin komplek seperti piridinium khlor kromat adalah oksidator
yang dapat merubah alkohol primer menjadi aldehid tanpa merubahnya
menjadi asam karboksilat (Petrucci, 1987).
Keton
adalah suatu senyawa organik yang mempunyai sebuah gugus karbonil
terikat pada dua gugus alkil, dua gugus alkil, atau sebuah alkil.
Keton juga dapat dikatakan senyawa organik yang karbon karbonilnya
dihubungkan dengan dua karbon lainnya. Keton tidak mengandung atom
hidrogen yang terikat pada gugus karbonil (Wilbraham, 1992).
Pembuatan
keton ynag paling umum adalah oksidasi dari alkohol sekunder. Hampir
semua oksidator dapat dipakai. Pereaksi yang khas antara lain
khromium oksida (CrO3), phiridinium khlor kromat, natrium bikhromat
(Na2Cr2O7) dan kalium permanganat (KMnO4) (Respati, 1986).
Reaksi-reaksi
pada aldehida dan keton adalah reaksi oksidasi dan reaksi reduksi.
Reaksi oksidasi untuk membedakan aldehida dan keton. Aldehid mudah
sekali dioksidasi, sedangkan keton tahan terhadap oksidator. Aldehida
dapat dioksidasi dengan oksidator yang sangat lemah. Sedangkan reaksi
reduksi terbagi menjadi tiga bagian yaitu reduksi menjadi alkohol,
reduksi menjadi hidrokarbon dan reduksi pinakol (Wilbraham, 1992).
Sifat-sifat
fisik aldehid dan keton, karena aldehid dan keton tidak mengandung
hidrogen yang terikat pada oksigen, maka tidak dapat terjadi ikatan
hidrogen seperti pada alkohol. Sebaliknya aldehid dan keton adalah
polar dan dapat membentuk gaya tarik menarik elektrostatik yang
relatif kuat antara molekulnya, bagian positif dari sebuah molekul
akan tertarik pada bagian negatif dari yang lain (Fessenden, 1997).
A.Iodoform
Iodoform
merupakan salah satu haloform yang terbentuk kristal berwarna
kuning,
dan sedikit larut dalam air. Secara umum haloform dibuat dari suatu
senyawa metil keton / metil aldehida atau dari senyawa yang bila
teroksidasi menghasilkan senyawa tersebut. Metil keton menghasilkan
endapan kuning iodoform jika direaksikan dengan iodine dalam larutan
NaOH.
R-C-CH3+
3 I2+ 4NaOH èR-C-ONa + 3 NaI + 3 H2O + CHI3
Metil
keton Iodoform kuning
Untuk
pembahasan ini, diasumsikan bahwa pereaksi yang kita gunakan adalah
larutan iodin dan natrium hidroksida. Tahap pertama melibatkan
substitusi ketiga atom hidrogen dalam gugus metil dengan atom-atom
iodin. Keberadaan ion-ion hidroksida cukup penting untuk
berlangsungnya reaksi ion-ion ini terlibat dalam mekanisme reaksi.
Pada
tahap kedua, ikatan antara C I3 dan ikatan lainnya pada molekul
terputus menghasilkan triiodometana (iodoform) dan garam dari sebuah
asam.
B.Tes
Benedict
Tes
benedict memberikan hasil positif bila terbentuk endapan merah bata.
Aldehida alifatik dioksidasi menjadi asam karboksilat dengan pereaksi
benedict( kompleks ion Cu(II) sitrat dalam larutan basa). Ion Cu(II)
direduksi menjadi Cu2O(endapan berwarna merah bata). Aldehida
aromatik dan keton tidak bereaksi dengan pereaksi benedict.
R-CHO
+ 2Cu2+ 5 OH è R-COO- + Cu2O + 3 H2O
Biru
merah bata
III.
Alat dan Bahan
A.Tes
Iodoform.
Alat
:
·Gelas
Beaker.
·Batang
Pengaduk.
·Kertas
Saring.
·Penanggas
Air.
·Timbangan
Analitik.
Bahan
:
·KI
·NaOCl
·Aseton
·Alkohol
B.Tes
Benedict.
Alat
:
·Pipet
Tetes.
·Tabung
Reaksi.
·Gelas
Beaker.
·Penanggas
Air.
Bahan
:
·Formaldehida.
·Aseton.
·Benzaldehida.
·Pereaksi
Benedict
- Cara Kerja
A.Tes
Iodoform.
B. Tes Benedict
V. Hasil Pengamatan
A. Tes Iodoform
B.Tes Benedict.
Larutan
|
Awal
|
Dipanaskan
|
Didinginkan
|
Benzaldehid
+
pereaksi benedict |
Biru
|
Biru
|
Terdapat
3 fase. Dan dibagian tengah terdapat pemisah seperti cincin
|
Aseton
+ pereaksi benedict
|
Biru
|
Biru
|
Sedikit
menyatu.terdapat sedikit lapisan diatasnya
|
Formaldehid
+ pereaksi benedict
|
Hijau
|
Biru
|
menyatu
|
VI. Pembahasan
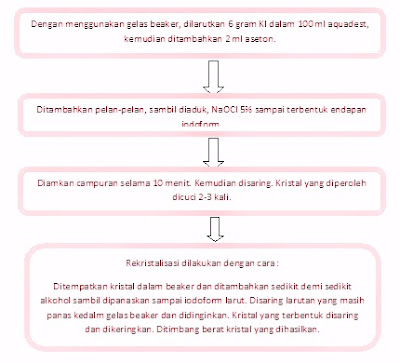
Percobaan pertama tentang tes iodoform. Reaksi
iodoform yaitu suatu reaksi yang spesifik terhadap senyawayang mengandung gugus metil keton. Gugus metil
dari suatu metil keton diiodinasi dalam suasana basa sampai terbentuk Iodoform (CHI3) padat berwarna kuning
Gugus
metil keton yang dipakai dalam percobaan ini adalah aseton,yang akan
direaksikan dengan iodium suasana basa menghasilkan Iodoform.Dan selanjutnya dilakukan proses rekristalisasi.
Dalam
percobaan ini dilakukan pengenceran aseton dengan air. Hal inidikarenakan pada
daerah tropis aseton mudah menguap. Dengan adanya penambahan air dapat
mencegah penguapan aseton.
NaOCl berfungsi sebagai suasana basa. Dalam percobaan ini, setelah iodoform habis bereaksi harus segera
ditambahkan sejumlah air karena bila iodoform telah habis bereaksi berarti
sudah terbentuk kristal iodoform. Tujuan penambahan air sesegera mungkin
adalah untuk menyempurnakan reaksi agar kristal yang dihasilkan bagus.
Adapun
faktor-faktor yang dapat menyebabkan kegagalan adalah penambahan NaOCl yang terlalu sedikit dan berlebih. Penambahan NaOCl
harus tepat karena jika terlalu sedikit, suasananya menjadi kurang basa
dan akibatnya kristal yang terbentuk sedikit. Sedangkan jika terlalu banyak
atau berlebih iodoform dapat larut dalam
NaOCl.
Rekristalisasi
adalah pemurnian zat padat dimana dalam keadaan panas larut dalam suatu pelarut
tertentu, tetapi dalam keadaan dingin atau pada suhu kamar, zat atau kristalnya
akan terjadi. Cara rekristalisasi dengan memanaskan pelarut tertentu yang
sesuai (dalam hal ini alkohol panas). Alkohol
± 50 ml dipanaskan di atas hot plate dengan diberi corong yang sudah
disumbat dengan kertas saring. Dimasukkan kristal iodoform yang sudah disaring
tersebutke dalam erlenmeyer, yang kemudian dilarutkan ke dalam alkohol panas.
Alkohol
dipanaskan di atas hot plate bukan di atas api bebas karena alkohol sifatnya
mudah terbakar maka menggunakan erlenmeyer yang ditutup dengan corong dan ditutup dengan kertas saring untuk menghindari
terjadinya penguapan alkohol.
alkohol
panas tersebut dimasukkan ke dalam erlenmeyer lain yang sudah berisi kristal
iodoform, penambahannya dilakukan sedikit demi sedikitsampai kristal
iodoformnya tepat larut. Jika alkohol ditambahkan berlebih maka kristal
iodoform yang larut saat panas nantinya akan sulit mengendap atau mengkristal
kembali.
Setelah itu dinginkan, lalu menambahkan air dan
segera disaringdengan corong. Hasil kristalnya yang terbentuk dikeringkan,
setelah kering hasilnya ditimbang. Diperoleh berat kristal iodoform sebesar 1.57 gram.
kedua adalah tes benedict, pada percobaan ini bertujuan untuk mengetahui reaksi pada aldehid dan keton dengan direaksikan dengana benedict. Larutan yang akan di uji dengan benedict adalah formaldehid, aseton dan benzaldehid.
Langkah pertama yang dilakukan adalah menyiapkan 3 buah tabung reaksi masing-masing diisi dengan 10 tetes formaldehid, aseton dan benzaldehid. kemudian pada masing-masing tabung ditambahkan 2 ml pereaksi benedict. Kemudian ditempatkan dalam penangas air yang bertujuan untuk mempercepat terjadinya reaksi. pada penambahan benedict ini tidak terjadi perubahan warna yang menunjukan positifnya tes benedict. penambahan benzaldehid dengan pereaksi benedict menghasilkan warna biru. penambahan pereaksi benedict pada aseton menghasilkan warna biru. dan penambahan pereaksi benedict pada formaldehid menghasilkan warna hijau. pada saat pemanasan, tidak terjadi perubahan pada benzaldehid dan aseton,namun terjadi perubahan warna menjadi biru dari warna hijau pada formaldehid + pereaksi benedict. setelah itu di lakukan pendinginan dengan cara dimasukkan ketiga tabung reaksi tersebut kedalam gelas beaker berisi air es. Setelah beberapa saat didiamkan, terjadi perubahan pada benzaldehid + pereaksi benedict yaitu Terdapat 3 fase. Dan dibagian tengah terdapat pemisah seperti cincin. dan pada aseton + pereaksi benedict terdapat pemisahan pada bagian atas atau terdapat 2 fase. pada formaldehid tidak terjadi apapun dan larutan homogen. pada teorinya, yang akan meunjukkan reaksi positif terhadap pereaksi benedict adalah formaldehid dengan reaksi
O O
| | |||||||
H – C – H + 2Cu+ + OH- à H – C – OH + CuO2 ↓ Merah bata + 3H2O
Hal ini dapat disebabkan oleh kesalahan praktikan dalam melakukan percobaan,kurang telitinya saat percobaan. dan dapat disebabkan pula dari bahan yang digunakan terkontaminasi dengan bahan lain.
VII. Kesimpulan
- pada percobaan tes iodoform dihasilkan berat kristal sebanyak 1.57 gram
- penambahan benzaldehid dengan pereaksi benedict menghasilkan warna biru. perubahan pada benzaldehid + pereaksi benedict yaitu Terdapat 3 fase. Dan dibagian tengah terdapat pemisah seperti cincin
- penambahan pereaksi benedict pada aseton menghasilkan warna biru. pada aseton + pereaksi benedict terdapat pemisahan pada bagian atas atau terdapat 2 fase.
- penambahan pereaksi benedict pada formaldehid menghasilkan warna hijau. pada formaldehid tidak terjadi apapun dan larutan homogen.
VIII. Daftar Pustaka
- · Fesenden, J Ralp, dan Joan s. Fessenden. 2006. Kimia Organik Jilid1. Terjemahan Aloysius Hadyana Pudjaatmaka. Jakarta: Penerbit Erlangga.
- · Siti Nurbayti, M.Si.2011. Penuntun Praktikum Kimia Organik I.Jakarta:UIN Syarif Hidayatullah.
- · http://triyasrahayu.blogspot.com/2011/10/laporan-organik-aldehid-dan-keton.html (19 November 2012)
- · http://alipart.blogspot.com/2011/03/identifikasi-aldehid-dan-keton.html (19 November 2012)
Lampiran
Tes benedict
Formaldehid + benedict
Formaldehid setelah dipanaskan
Ketiga sampel saat pendinginan
Ketiga sampel setelah pendinginan
dari kiri ke kanan
(aseton,benzaldehid,formaldehid)
terlihat jelas cincin pada benzaldehid setelah pendinginan